Характеристика серной кислоты
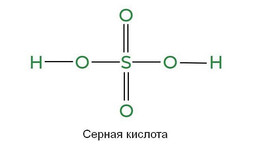
Серная кислота – неорганическое вещество с выраженными окислительными свойствами. Формула соединения H2SO4. Для промышленных целей ее добывают методом окисления диоксида серы, а его – способом сжигания металлических сульфидов или серы. На следующей стадии диоксид превращают в триоксид и далее в серную кислоту.
Свойства вещества
Серная кислота обладает выраженной способностью вступать в реакции с металлами и неметаллами, вызывать коррозию, окислять. Ее рН составляет 2,8.
Ее основные свойства:
| Дополнительные названия | Тетраоксосульфат водорода, купоросное масло |
| Агрегатное состояние | Жидкость без цвета и без запаха, слегка маслянистая |
| Растворимость в воде | Высокая, смешивается с водой в любых пропорциях, сильно гигроскопичная, поглощает пары воды из воздуха |
| Температура кипения | +337оС |
| Температура плавления | +10 оС |
| Плотность | 1,84 г/см3 |
H2SO4 окисляет многие металлы, но не способна реагировать с платиной и золотом, на поверхности железа, хрома и алюминия провоцирует появление оксидной пленки. Из неметаллов она окисляет углерод, серу и фосфор. Соединение относится к сильным электролитам, в водных растворах диссоциирует полностью. С солями бария дает специфическую реакцию с появлением белого осадка в виде кристаллов, которые применяют для качественного определения сульфат-ионов.
Сферы применения
В промышленности кислоту используют в разной степени разведения: от 10 % для регуляции рН, обезвоживания, реактива до концентрации 98% для длительного хранения, химического синтеза. Серная кислота необходима для разных процессов:
- Для сельского хозяйства она нужна для производства минеральных удобрений: фосфатов и суперфосфатов.
- В химическом синтезе ее используют, чтобы получать другие кислоты: фосфорную, азотную, соляную.
- В военном деле серная кислота необходима при производстве тротила и других видов взрывчатки.
- Для нефтехимии – это основной осушитель, чтобы удалить влагу из керосина, парафина, масел.
- При добыче полезных ископаемых серная кислота помогает обогащать медную руду.
- Для автомобилистов это соединение присутствует в аккумуляторах свинцово-кислотного типа, требуется для получения изооктана – присадки для бензина.
H2SO4 используют для изготовления моющих средств, душистых соединений, перекиси водорода.
Безопасность соединения
Это едкое вещество при попадании на кожу вызывает ожоги, при попадании на ткань сильно повреждает ее. Контакт с глазами приводит к потере зрения, а вдыхание паров провоцирует жжение, сильную одышку. Самостоятельно она не относится к взрывоопасным, но бурно реагирует при контакте с другими соединениями, при смешивании с водой выделяет большое количество тепла, из-за чего всегда нужно вливать кислоту в воду. H2SO4 относится к 2 классу опасности.